Validação de Sistemas Computadorizados
A validação de sistemas informatizados comprova que ele desempenha corretamente suas funções, com segurança e rastreabilidade dos processos. É essencial para indústrias farmacêutica, cosmética, saneantes, entre outras.
O que é Validação de Sistemas Computadorizados?
A validação de sistemas computadorizados é o processo de garantir que um sistema funcione conforme o esperado, seja seguro e cumpra todos os requisitos regulatórios. Utiliza guias como o GAMP5 e a FDA 21 CFR Parte 11, além do Guia de Validação de Sistemas da ANVISA.




Quando Fazer a Validação de Sistemas?
Segurança do Paciente


Assegura que os sistemas mantenham a integridade e a segurança dos produtos, evitando riscos à saúde.




Conformidade Regulamentar
Atende aos requisitos de órgãos regulatórios como ANVISA e FDA, assegurando conformidade com normas como GAMP5 e FDA 21 CFR Parte 11.
Protege contra adulteração, assegurando que registros eletrônicos sejam invioláveis, com trilhas de auditoria e controle de acesso.
Integridade de Dados
A validação deve ser realizada antes da implementação do sistema e revisada periodicamente, especialmente após modificações significativas ou atualizações.
Etapas do Processo de Validação de Sistemas Computadorizados:
1. Planejamento
Plano de Validação:
Desenvolvido pelo usuário ou consultoria, o plano de validação detalha todas as atividades necessárias para assegurar que o sistema atenda aos requisitos do usuário e regulatórios.Análise de Riscos:
Identificação e mitigação de riscos potenciais que possam afetar a funcionalidade ou a conformidade do sistema. A análise de risco é essencial para priorizar esforços de validação.URS (User Requirement Specifications):
Definição das especificações do usuário, descrevendo todas as funcionalidades e requisitos necessários para o sistema.
2. Execução
Plano de Qualidade e Projeto:
Criado pelo fornecedor e revisado pelo usuário, este plano detalha como o sistema será projetado e construído para atender aos requisitos do URS.Especificação Funcional e Hardware Design:
Documentação das funcionalidades necessárias e a arquitetura do sistema, assegurando que todos os componentes funcionem corretamente juntos.Protocolos de Testes FAT, QI/QO, QD:




FAT (Factory Acceptance Test): Verifica se o sistema atende às especificações em ambiente controlado.
QI (Qualificação de Instalação): Confirma que o sistema foi instalado corretamente e está pronto para operação.
QO (Qualificação de Operação): Testa as funcionalidades operacionais básicas do sistema.
QD (Qualificação de Desempenho): Avalia o desempenho do sistema em condições operacionais reais.
3. Conclusão
Relatório de Validação: Documento final que compila todos os resultados dos testes, verificações e avaliações realizadas, confirmando que o sistema está em conformidade com todos os requisitos estabelecidos.
Arquivos Eletrônicos Invioláveis:
Banco de dados e arquivos protegidos contra adulteração.
Trilha de Auditoria:
Registro detalhado de todas as operações e alterações no sistema.
Elementos Essenciais:
Controle de Acesso:
Restrições para garantir que apenas usuários autorizados possam acessar e modificar o sistema.
Assinatura Eletrônica:
Para validação de usuários e ações, garantindo a autenticidade e a responsabilidade.
Fluxo operacional
O seguinte fluxo operacional é desenvolvido para mitigar os riscos para que, então, possam ser classificados ou categorizados, respectivamente, conforme da Guia da Anvisa ou GAMP5 tipos.
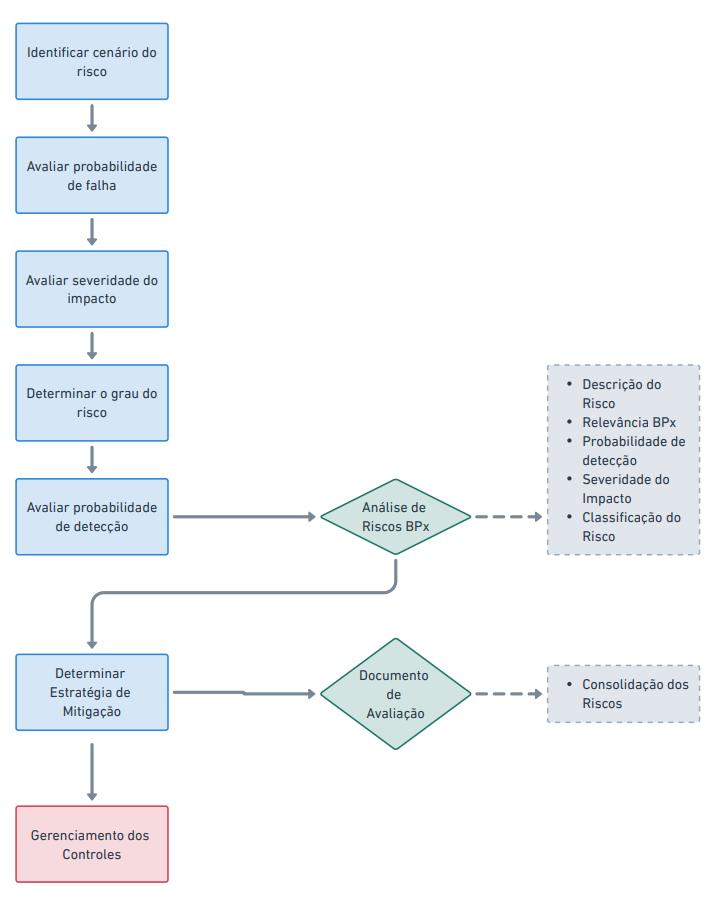
Cada etapa é realizada com base na análise de riscos, conforme os guias da ANVISA e GAMP5, garantindo que todos os processos estejam documentados e em conformidade com as normas.
Referências e Normativas


Guia de Validação de Sistemas Computadorizados da ANVISA
A principal referência para a execução da validação de sistemas na área da saúde é o Guia de Validação de Sistemas Computadorizados da ANVISA. Este guia, junto com referências internacionais como o GAMP5 (Good Automated Manufacturing Practice), fornece uma estratégia de validação baseada em risco GxP.
GAMP5 e BPx
GxP é um termo geral que se refere às boas práticas aplicáveis a qualquer área, como fabricação, distribuição, ensaios clínicos e laboratórios. No contexto da ANVISA, GxP é traduzido como BPx. Um sistema BPx adequado é crucial para garantir a saúde do paciente, a qualidade do produto e a integridade dos dados.
Importância da Validação


A validação de sistemas informatizados não é apenas um requisito regulatório, mas uma necessidade para garantir a eficiência, segurança e conformidade dos processos da sua empresa. Implementar um sistema validado significa ter a certeza de que todos os processos automáticos são realizados corretamente, protegendo a integridade dos dados e a qualidade dos produtos.
